Mg или магний — это химический элемент, находящийся во второй группе периодической таблицы, с атомным номером 12 и соответствующим порядковым номером в периодической таблице. Как щелочноземельный элемент, магний классифицируется как металл.
Атомная структура магния включает три стабильных изотопа 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%).
Атомная масса магния 24,305. Магний и магнезиум являются эквивалентными терминами; магнезиум — это просто латинское название этого элемента.
Первоначально магний был обнаружен в 1625 году в составе соли Эпсома (также известной как соль Эпсона), однако только в 1809 году английский химик Хамфри Дэви успешно получил чистый магний в процессе электролиза и таким образом назвал этот элемент.
Свойства магния
Перечислим основные свойства магния:
- Поперечное сечение захвата тепловых нейтронов для природной смеси изотопов 5,9 ·10-20 м2.
- Конфигурация внешней электронной оболочки 3s2.
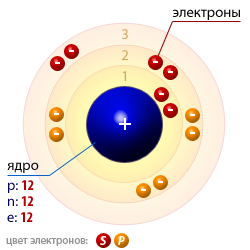
Атомное ядро магния - Степень окисления +2, очень редко +1.
- Энергии ионизации Mg0→ Mg+ → Mg2+ равны соотв. 7,64607 и 15,0353 эВ.
- Электроотрицательность по Полингу 1,2.
- Сродство к электрону -0,22 эВ.
- Атомный радиус 0,160 нм.
- Ионные радиусы для Mg2+ (в скобках указаны координационные числа) 0,071 нм (4), 0,08 нм (5), 0,086 нм (6), 0,103 нм (8).
Магний в природе
Содержание магния в земной коре 2,35% по массе. Встречается в природе только в виде соединений. Известно более 100 минералов, содержащих магний.

Большинство из них — силикаты и алюмосиликаты, например оливин (Mg,Fe)2[SiO4], серпентин Mg6(OH)8[Si4O10].
Образуют залежи промышленного значения главным образом:
- магнезит MgCO3,
- доломит CaMg(CO3)2
- асбест,
- бишофит MgCl2·6H2O,
- карналлит KCl·MgCl2·6H2O,
- кизерит MgSO4·H2O,
- эпсомит MgSO4·7H2O,
- каинит KCl·MgSO4·3H2O,
- астраханит Na2SO·MgSO4·4H2O.
Запасы хлоридных калийно-магниевых солей сосредоточены в различных странах, таких как Россия, Германия, Испания, США. С другой стороны, карбонатные минералы встречаются в Чехии, Китае, Австрии, Греции и других странах. Природные рассолы и морская вода являются источниками магния.
Магний является важным компонентом молекулы хлорофилла, и его всегда можно найти в растениях.
Физические характеристики магния
Магний представляет собой серебристо-белый металл с гексагональной кристаллической решеткой с пространственной группой P63/tts. Параметры решетки: a = 0,3210 нм, c = 0,5200 нм, z = 2.
Температура плавления магния 650°С, а его температура кипения 1105°С. Плотность магния составляет 1,74 г/см3 при 20°С и 1,54 г/см3 при 700°С. Теплоемкость магния 24,90 Дж/(моль·К), теплота плавления 8,5 кДж/моль при 923 К. Магний имеет энтропию 32,68 Дж/(моль·К).
Уравнения температурной зависимости давления паров над твердым и жидким магнием имеют вид:
lgp(мм рт. ст.) = 9,7124 — 7753,5/T — 2,453·10-4T — 0,2293 lgT (298-1390 К),
lgр(мм рт. ст.) = 16,7974 — 7844,2/T + 2,548·10-4T — 2,7280 lgT (407-1390 К).
- Коэффициент линейного расширения магния α = 25,0.10-6 + 0,0188 t °С-1 (0 — 550 °С).
- Теплопроводность 155 Вт/(м·К).
- Удельное сопротивление магния 4,49·10-8 Ом·м
При магнитной восприимчивости +0,5·10^(-6) магний проявляет парамагнетизм.
Магний — ковкий и пластичный металл с относительно мягкими характеристиками. Его прочность и твердость минимальны у литых образцов и выше у прессованных и кованых. Предел текучести составляет 25-90 МПа, твердость по Бринеллю — 300-350 МПа, относительное удлинение — 8,0-11,5%.
Взаимодействие магния с различными веществами
Поверхность магния обычно защищена прочной пленкой оксида магния, MgO, и только при нагревании на воздухе примерно до 600°C эта пленка разрушается, в результате чего металл сгорает с ослепительно белым пламенем, образуя MgO и нитрид Mg3N2. Магний не реагирует с холодной водой, но вытесняет H2 из кипящей воды, создавая гидроксид магния Mg(OH)2. Степень окисления магния в оксиде магния составляет +2, что является высшей степенью в соответствии с его положением в периодической таблице.
Аналогично ведет себя магний при воздействии растворов солей аммония. Интенсивно реагирует с разбавленными кислотами при комнатной температуре, но в холодных концентрированных H2SO4 и HNO3 не реагирует. Кроме того, за счет образования защитной пленки MgF2 магний непроницаем для HF и плавиковой кислоты.
Магний соединяется с галогенами с образованием галогенидов магния MgX2.
Гидрид магния
В условиях температуры 570°С и давления ~20 МПа гидрид магния (MgH2) образуется в присутствии MgI2 и представляет собой кристаллы серого цвета с решеткой типа рутила. Это соединение имеет плотность 1,45 г/см3, стабильно на воздухе, медленно реагирует с водой с образованием Mg(OH)2 и H2 и разлагается на свои элементы при температуре выше 280°C. Кроме того, гидрид магния можно получить в виде бесцветного твердого вещества в результате реакции алкилов магния с LiH, который воспламеняется на воздухе и бурно реагирует с водой.
Нитрит магния
В интервале температур 780-800°С магний реагирует с N2 с образованием нитрита магния (Mg3N2), который представляет собой желтоватые кристаллы с кубической решеткой типа Mn2O3 (α-форма) и плотностью 2,71 г/см3. При 550°С а-форма переходит в β-форму, которая затем переходит в γ-модификацию при 778°С. При контакте с водой нитрид магния реагирует с образованием Mg(OH)2 и NH3. Другим способом получения нитрида магния является взаимодействие сухого NH3 с магнием при температуре 600°С.
Халькогениды
Халькогениды образуются при нагревании магния с S, Se или Te с образованием бесцветных кристаллов, которые гидролизуются водой. Сульфид MgS образует кристаллы кубической решетки с твердостью плавления около 2200°С, плотностью 2,86 г/см3, теплоемкостью 45,6 Дж/(моль К), температурой плавления -348 кДж/моль и энтропией 50,3 Дж/моль. (моль К). Сульфид также можно получить нагреванием магния с H2S.
Бориды
Когда магний нагревается с бором, он образует темно-коричневые твердые вещества, такие как бориды MgB2, MgB4, MgB6, MgB12.
MgB2 медленно реагирует с водой и бурно реагирует с разбавленными кислотами с образованием боргидридов. Бориды с более высокими концентрациями бора не реагируют с разбавленными кислотами при комнатной температуре.
Карбиды
Магний реагирует с углеродом с образованием карбидов, таких как MgC2 и MgC3. Эти карбиды реагируют с водой с образованием C2H2 и смесей углеводородов, в которых преобладает аллен C3H4.
Силицид
С кремнием магний образует силицид Mg2Si (температура плавления 1102°C), который разлагается водой с выделением SiH4 и других силанов.
Взаимодействие с металлами
Магний образует интерметаллиды со многими металлами. Восстанавливает CO2, B2O3, SiO2, галогениды металлов до соответствующего элемента.
Соли магния
Соли магния получают взаимодействием кислот или соответствующих им оксидов с MgO, действием разбавленных кислот на металлический магний и обменными реакциями. Многие соли хорошо растворимы в воде с небольшим гидролизом и образуют кристаллогидраты. В водных растворах ион Mg2+ существует в виде аквакомплекса [Mg(H2O)6]2+.
В неводных растворителях (жидкий NH3) ион Mg2+ образует комплекс с молекулами растворителя. Сольваты солей магния обычно кристаллизуются из таких растворов. Кристаллосольваты разрушаются с образованием аквакомплексов в водной среде. При взаимодействии щелочей с водными растворами солей магния Mg(OH)2 выпадает в осадок.
Получение магния
Преобладающий промышленный способ получения магния — электролиз расплава смеси безводных MgCl2, KCl и NaCl. Для получения расплава используют обезвоженный карналлит или бишофит, а также MgCl2, полученный хлорированием MgO или как отход при производстве Ti. Температура электролиза 700-720 °С, аноды графитовые, катоды стальные.

Концентрация MgCl2 в расплаве обычно составляет 5-8%. Снижение концентрации до 4 % приводит к снижению выхода магния по току, а увеличение концентрации выше 8 % приводит к увеличению расхода электроэнергии.
Для обеспечения оптимального содержания MgCl2 часть отработанного электролита периодически заменяют свежим карналлитом или MgCl2.
Жидкий магний поднимается на поверхность электролита и извлекается вакуумным ковшом, в результате чего получается магний-сырец, содержащий 0,1% примесей. Хлориды или фториды K, Ba, Na и Mg используются в качестве флюсов для удаления неметаллических примесей. Вакуумная перегонка, зонная плавка или электролитическое рафинирование используются для глубокой очистки с получением магния чистотой 99,999%.
Помимо магния, при электролизе также образуется Cl2.
Магнезит или доломит используются в качестве сырья для производства термического магния. MgO получают прокаливанием с последующим восстановлением до металла в ретортных или вращающихся печах с графитовыми или угольными нагревателями. Применяют силикотермический метод, карбидотермический метод или карботермический метод с диапазоном температур от 1280-1300°С до более 2100°С. Карботермический метод (MgO + C → Mg + CO) быстро охлаждает смесь паров СО и магния инертным газом на выходе из печи, чтобы предотвратить обратную реакцию СО с магнием.
Применение
Основным применением магния является производство его сплавов. Магний также используется для легирования сплавов на основе алюминия и других материалов, а также для металлотермического производства различных металлов, таких как титан, уран, цирконий и ванадий.
Кроме того, магний используется для раскисления и десульфурации некоторых металлов и сплавов, а также в синтезе магнийорганических соединений, таких как реактив Гриньяра.
Смеси, содержащие порошок магния и окислители, применяют при приготовлении светотехнических и зажигательных составов. Магний также используется в создании лекарств для устранения недостатка магния в организме.


Чего только не бывает в мире химии.
Круто.
Спасибо.